Seramida

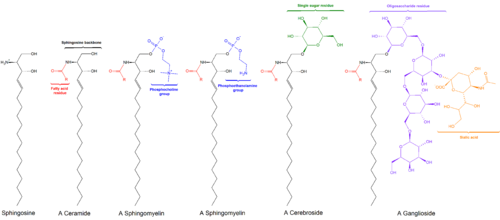
Seramida adalah keluarga molekul lipid zat malam. Seramida terdiri dari sfingosina dan asam lemak yang disatukan oleh ikatan amida. Seramida ditemukan dalam konsentrasi tinggi di dalam membran sel eukariotik, karena merupakan komponen lipid yang membentuk sfingomielin, salah satu lipid utama dalam lapisan lipid ganda.[1] Bertentangan dengan asumsi sebelumnya bahwa seramida dan sfingolipid lain yang ditemukan di membran sel murni merupakan elemen struktural pendukung, seramida dapat berpartisipasi dalam berbagai pensinyalan seluler: contohnya termasuk mengatur diferensiasi, proliferasi, dan kematian sel terprogram (PCD) pada sel.
Kata seramida berasal dari bahasa Latin cera (zat malam) dan amide. Seramida merupakan komponen vernix caseosa, zat putih seperti malam atau keju yang ditemukan melapisi kulit bayi manusia yang baru lahir.
Jalur sintesis seramida
Hidrolisis sfingomielin
Hidrolisis sfingomielin dikatalisis oleh enzim sfingomielinase. Karena sfingomielin adalah salah satu dari empat fosfolipid umum yang ditemukan dalam membran plasma sel, implikasi dari metode pembuatan seramida ini adalah bahwa membran sel merupakan target sinyal ekstraseluler yang mengarah pada kematian sel terprogram. Telah ada penelitian yang menunjukkan bahwa ketika radiasi pengion menyebabkan apoptosis pada beberapa sel, radiasi tersebut menyebabkan aktivasi sfingomielinase dalam membran sel dan akhirnya, pada pembentukan seramida.[2]
De novo
Sintesis seramida secara de novo dimulai dengan kondensasi palmitat dan serina untuk membentuk 3-keto-dihidrosfingosin. Reaksi ini dikatalisis oleh enzim serina palmitoiltransferase dan merupakan langkah pembatas laju dari jalur tersebut. Pada gilirannya, 3-keto-dihidrosfingosin direduksi menjadi dihidrosfingosin, yang kemudian diikuti oleh asilasi oleh enzim (dihidro)seramida sintase untuk menghasilkan dihidroseramida. Reaksi akhir untuk menghasilkan seramida dikatalisis oleh dihidroseramida desaturase. Sintesis seramida secara de novo terjadi di retikulum endoplasma. Seramida selanjutnya diangkut ke badan Golgi baik melalui pengangkutan vesikular maupun protein transfer seramida CERT. Setelah berada di badan Golgi, seramida dapat dimetabolisme lebih lanjut menjadi sfingolipid lain, seperti sfingomielin dan glikosfingolipid kompleks.[3]
Jalur penyelamatan
Degradasi konstitutif sfingolipid dan glikosfingolipid terjadi di kompartemen subselular asam, endosom akhir, dan lisosom; dengan tujuan akhir menghasilkan sfingolipid. Dalam kasus glikosfingolipid, eksohidrolase yang bekerja pada pH asam optimum menyebabkan pelepasan unit monosakarida secara bertahap dari ujung rantai oligosakarida, sehingga hanya menyisakan bagian sfingosin dari molekul tersebut, yang kemudian dapat berkontribusi pada pembentukan seramida. Seramida dapat dihidrolisis lebih lanjut oleh seramidase asam untuk membentuk sfingosin dan asam lemak bebas, yang keduanya dapat meninggalkan lisosom, tidak seperti seramida. Basa sfingoid rantai panjang yang dilepaskan dari lisosom kemudian dapat memasuki kembali jalur untuk sintesis seramida dan/atau sfingosin-1-fosfat. Jalur penyelamatan menggunakan kembali basa sfingoid rantai panjang untuk membentuk seramida melalui aksi sintase seramida. Dengan demikian, anggota keluarga sintase seramida mungkin memerangkap sfingosin bebas yang dilepaskan dari lisosom di permukaan retikulum endoplasma atau di membran yang terkait dengan retikulum endoplasma. Jalur penyelamatan diperkirakan berkontribusi 50% hingga 90% dari biosintesis sfingolipid.[4]
Peran fisiologis
Patologi
Sebagai lipid bioaktif, seramida telah terlibat dalam berbagai fungsi fisiologis termasuk apoptosis, penghentian pertumbuhan sel, diferensiasi, penuaan sel, migrasi sel, dan adhesi.[3] Peran seramida dan metabolit hilirnya juga telah disarankan dalam sejumlah kondisi patologis termasuk kanker, neurodegenerasi, diabetes melitus, patogenesis mikroba, obesitas, dan peradangan.[5][6]
Beberapa seramida yang berbeda secara ampuh memprediksi kejadian kardiovaskular yang merugikan (MACE), yaitu C16:0, C18:0, dan C24:1, meskipun C24:0 memiliki hubungan terbalik.[7][8] C16-C18 berbahaya di hati.[7] Kadar seramida berkorelasi positif dengan peradangan dan stres oksidatif di hati, dan timbulnya dan perkembangan penyakit perlemakan hati non-alkoholik (NAFLD) dikaitkan dengan peningkatan seramida di hepatosit.[8] Asupan lemak jenuh dari makanan telah terbukti meningkatkan serum seramida dan meningkatkan resistensi insulin.[7] Meskipun penelitian awal menunjukkan peningkatan resistensi insulin pada otot, penelitian selanjutnya juga menunjukkan peningkatan resistensi insulin pada hati dan jaringan adiposa.[8] Intervensi yang membatasi sintesis seramida atau meningkatkan degradasi seramida menghasilkan peningkatan kesehatan (misalnya penurunan resistensi insulin dan penurunan penyakit hati berlemak).[7]
Seramida menginduksi resistensi insulin otot rangka ketika disintesis sebagai hasil aktivasi reseptor TLR4 oleh lemak jenuh. Lemak tak jenuh tidak memiliki efek ini.[9] Seramida menginduksi resistensi insulin di banyak jaringan melalui penghambatan sinyal Akt/PKB.[10] Agregasi kolesterol LDL oleh seramida menyebabkan retensi LDL di dinding arteri, yang menyebabkan aterosklerosis.[11] Seramida menyebabkan disfungsi endotel dengan mengaktifkan protein fosfatase 2 (PP2A).[12] Di mitokondria, seramida menekan rantai transpor elektron dan menginduksi produksi spesies oksigen reaktif.[13]
Apoptosis
Salah satu peran seramida yang paling banyak dipelajari berkaitan dengan fungsinya sebagai molekul proapoptotik. Apoptosis, atau kematian sel terprogram Tipe I, sangat penting untuk mempertahankan homeostasis sel normal dan merupakan respons fisiologis penting terhadap berbagai bentuk stres sel. Akumulasi seramida telah ditemukan setelah perawatan sel dengan sejumlah agen apoptosis, termasuk radiasi pengion,[2][14] sinar UV,[15] TNF-alfa,[16] dan agen kemoterapi. Hal ini menunjukkan peran seramida dalam respons biologis semua agen ini. Karena efeknya yang menginduksi apoptosis pada sel kanker, seramida telah disebut sebagai "lipid penekan tumor". Beberapa penelitian telah berupaya untuk lebih jauh mendefinisikan peran spesifik seramida dalam peristiwa kematian sel dan beberapa bukti menunjukkan fungsi seramida di hulu mitokondria dalam menginduksi apoptosis. Namun, karena sifat penelitian yang saling bertentangan dan bervariasi mengenai peran seramida dalam apoptosis, mekanisme yang digunakan lipid ini untuk mengatur apoptosis masih belum jelas.[17]
Kulit
Stratum korneum adalah lapisan terluar epidermis.[18][19][20] Stratum korneum terdiri dari korneosit yang berdiferensiasi dan terenukleasi secara terminal yang berada dalam matriks lipid, seperti "batu bata dan mortar." Bersama dengan kolesterol dan asam lemak bebas, seramida membentuk mortar lipid, penghalang kedap air yang mencegah hilangnya air akibat penguapan. Sebagai aturan praktis, matriks lipid epidermis terdiri dari campuran ekuimolar seramida (~50% berat), kolesterol (~25% berat), dan asam lemak bebas (~15% berat), dengan jumlah lipid lain yang lebih sedikit juga hadir.[21][22] Penghalang lipid juga melindungi dari masuknya mikroorganisme.[20]
Seramida epidermis memiliki keragaman struktur dan secara garis besar dapat diklasifikasikan sebagai seramida AS dan NS; dihidroseramida ADS dan NDS; AH, EOH, dan NH 6-hidroksiseramida; fitoseramida AP dan NP; serta asilseramida EOH dan EOS, lihat gambar.

Keragaman struktur seramida tidak diragukan lagi memainkan peran penting dalam atribut unik stratum korneum di berbagai lokasi tubuh. Misalnya, stratum korneum wajah tipis dan fleksibel untuk mengakomodasi berbagai ekspresi wajah. Sebaliknya, stratum korneum yang menutupi tumit kaki tebal dan kaku untuk melindungi dari trauma. Sesuai dengan perubahan struktural ini, terdapat perubahan spesifik lokasi tubuh pada lipidom epidermis, termasuk perubahan dalam kelimpahan relatif berbagai struktur seramida epidermis.[18]
Mirip dengan perubahan spesifik lokasi tubuh dalam kelimpahan seramida, terdapat juga perubahan yang terkarakterisasi dengan baik dalam ekspresi seramida epidermal pada pasien dengan penyakit kulit inflamasi. Pada psoriasis kelainan hiperplastik, peneliti telah melaporkan peningkatan pada seramida AS dan NS serta penurunan pada seramida EOS, AP, dan NP, yang dapat menyebabkan kerusakan pada penghalang kedap air pada kulit.[22][23][24] Dengan mempelajari ekspresi seramida pada pasien dermatitis atopik dan psoriasis, peneliti lain telah melaporkan bahwa alih-alih berfokus pada kelas seramida, panjang basa sfingoid seramida dan panjang rantai asam lemak memiliki pengaruh terkuat pada kemungkinan struktur seramida tertentu mengalami peningkatan atau penurunan regulasi pada kulit yang meradang.[18] Kadar seramida pada kulit, rambut, dan kuku dapat berkurang karena perubahan lingkungan (seperti udara kering/tercemar), penggunaan sulfat yang keras, panas yang berlebihan (termasuk penataan rambut yang panas), paparan sinar UV, dan penuaan biologis.[25]
Hormonal
Penghambatan sintesis seramida dengan miriosin pada mencit obesitas dapat menyebabkan peningkatan sinyal leptin dan penurunan resistensi insulin dengan menurunkan ekspresi SOCS-3.[26] Peningkatan kadar seramida dapat menyebabkan resistensi insulin dengan menghambat kemampuan insulin untuk mengaktifkan jalur transduksi sinyal insulin dan/atau melalui aktivasi JNK.[27]
Zat yang diketahui dapat menginduksi pembentukan seramida
- Anandamida
- Penghambat seramidase
- Agen kemoterapi
- Ligan fas
- Endotoksin
- Homosisteina[28]
- Panas
- Sfinganina hidroksipalmitoil[29][30]
- Interferon gama
- Radiasi pengion[2][31]
- Metaloproteinase matrikss[28]
- Niasinamida
- Spesies oksigen reaktif[28]
- Tetrahidrokanabinol dan kanabinoid lain[32]
- Faktor nekrosis tumor-alfa[28]
- 1,25 Dihydroxy vitamin D
Penyakit terkait
Pada penyakit metabolik gabungan malonik dan metilmalonik aciduria (CMAMMA) yang disebabkan oleh ACSF3, terjadi perubahan komposisi lipid kompleks yang sangat besar akibat gangguan sintesis asam lemak mitokondria (mtFAS).[33][34] Misalnya, sementara konsentrasi sfingomielin meningkat secara nyata, konsentrasi seramida menurun secara proporsional.[33]
Kegunaan
Seramida dapat ditemukan sebagai bahan dalam beberapa obat topikal kulit yang digunakan untuk melengkapi pengobatan kondisi kulit seperti eksem.[35] Seramida juga digunakan dalam produk kosmetik seperti beberapa sabun, sampo, krim kulit, dan tabir surya.[36] Selain itu, seramida juga sedang dieksplorasi sebagai terapi potensial dalam mengobati kanker.[37]
Seramida pada bakteri
Seramida jarang ditemukan pada bakteri.[38]
Referensi
- ^ Davis, Deanna; Kannan, Muthukumar; Wattenberg, Binks (2018-12-01). "Orm/ORMDL proteins: Gate guardians and master regulators". Advances in Biological Regulation. Sphingolipid Signaling in Chronic Disease. 70: 3–18. doi:10.1016/j.jbior.2018.08.002. ISSN 2212-4926. PMC 6251742. PMID 30193828.
- ^ a b c Haimovitz-Friedman A, Kan CC, Ehleiter D, et al. (1994). "Ionizing radiation acts on cellular membranes to generate ceramide and initiate apoptosis". J. Exp. Med. 180 (2): 525–35. doi:10.1084/jem.180.2.525. PMC 2191598. PMID 8046331.
- ^ a b Hannun, Y.A.; Obeid, L.M. (2008). "Principles of bioactive lipid signalling: lessons from sphingolipids". Nature Reviews Molecular Cell Biology. 9 (2): 139–150. doi:10.1038/nrm2329. PMID 18216770. S2CID 8692993.
- ^ Kitatani K, Idkowiak-Baldys J, Hannun YA (2008). "The sphingolipid salvage pathway in ceramide metabolism and signaling". Cell Signaling. 20 (6): 1010–1018. doi:10.1016/j.cellsig.2007.12.006. PMC 2422835. PMID 18191382.
- ^ Zeidan, Y.H.; Hannun, Y.A. (2007). "Translational aspects of sphingolipid metabolism". Trends Mol. Med. 13 (8): 327–336. doi:10.1016/j.molmed.2007.06.002. PMID 17588815.
- ^ Wu D, Ren Z, Pae M, Guo W, Cui X, Merrill AH, Meydani SN (2007). "Aging up-regulates expression of inflammatory mediators in mouse adipose tissue". The Journal of Immunology. 179 (7): 4829–39. doi:10.4049/jimmunol.179.7.4829. PMID 17878382.
- ^ a b c d Tippetts TS, Holland WL, Summers SA (2021). "Cholesterol - the devil you know; ceramide - the devil you don't". Trends in Pharmacological Sciences. 42 (12): 1082–1095. doi:10.1016/j.tips.2021.10.001. PMC 8595778. PMID 34750017.
- ^ a b c Zhu C, Huai Q, Zhang X, Dai H, Li X, Wang H (2023). "Insights into the roles and pathomechanisms of ceramide and sphigosine-1-phosphate in nonalcoholic fatty liver disease". International Journal of Biological Sciences. 19 (1): 311–330. doi:10.7150/ijbs.78525. PMC 9760443. PMID 36594091.
- ^ Holland WL, Bikman BT, Wang LP, Yuguang G, Sargent KM, Bulchand S, Knotts TA, Shui G, Clegg DJ, Wenk MR, Pagliassotti MJ, Scherer PE, Summers SA (2011). "Lipid-induced insulin resistance mediated by the proinflammatory receptor TLR4 requires saturated fatty acid-induced ceramide biosynthesis in mice". Journal of Clinical Investigation. 121 (5): 1858–1870. doi:10.1172/JCI43378. PMC 3083776. PMID 21490391.
- ^ Chavez JA, Siddique MM, Wang ST, Ching J, Shayman JA, Summers SA (2014). "Ceramides and glucosylceramides are independent antagonists of insulin signaling". Journal of Biological Chemistry. 289 (2): 723–734. doi:10.1074/jbc.M113.522847. PMC 3887200. PMID 24214972.
- ^ Li Z, Basterr MJ, Hailemariam TK, Hojjati MR, Lu S, Liu J, Liu R, Zhou H, Jiang XC (2005). "The effect of dietary sphingolipids on plasma sphingomyelin metabolism and atherosclerosis". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1735 (2): 130–134. doi:10.1016/j.bbalip.2005.05.004. PMID 15967715.
- ^ Mehra VC, Jackson E, Zhang XM, Jiang XC, Dobrucki LW, Yu J, Bernatchez P, Sinusas AJ, Shulman GI, Sessa WC, Yarovinsky TO, Bender JR (2014). "Ceramide-activated phosphatase mediates fatty acid-induced endothelial VEGF resistance and impaired angiogenesis". The American Journal of Pathology. 184 (5): 1562–1576. doi:10.1016/j.ajpath.2014.01.009. PMC 4005977. PMID 24606881.
- ^ Kogot-Levin A, Saada A (2014). "Ceramide and the mitochondrial respiratory chain". Biochimie. 100: 88–94. doi:10.1016/j.biochi.2013.07.027. PMID 23933096.
- ^ Dbaibo GS, Pushkareva MY, Rachid RA, Alter N, Smyth MJ, Obeid LM, Hannun YA (1998). "p53-dependent ceramide response to genotoxic stress". J. Clin. Invest. 102 (2): 329–339. doi:10.1172/JCI1180. PMC 508891. PMID 9664074.
- ^ Rotolo JA, Zhang J, Donepudi M, Lee H, Fuks Z, Kolesnick R (2005). "Caspase-dependent and -independent activation of acid sphingomyelinase signaling". J. Biol. Chem. 280 (28): 26425–34. doi:10.1074/jbc.M414569200. PMID 15849201.
- ^ Dbaibo GS, El-Assaad W, Krikorian A, Liu B, Diab K, Idriss NZ, El-Sabban M, Driscoll TA, Perry DK, Hannun YA (2001). "Ceramide generation by two distinct pathways in tumor necrosis factor alpha-induced cell death". FEBS Letters. 503 (1): 7–12. doi:10.1016/S0014-5793(01)02625-4. PMID 11513845. S2CID 85367540.
- ^ Taha TA, Mullen TD, Obeid LM (2006). "A house divided: ceramide, sphingosine, and sphingosine-1-phosphate in programmed cell death". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12): 2027–36. doi:10.1016/j.bbamem.2006.10.018. PMC 1766198. PMID 17161984.
- ^ a b c d Merleev, AA; Le, ST; Alexanian, C; Toussi, A; Xie, Y; Marusina, AI; Watkins, SM; Patel, F; Billi, AC; Wiedemann, J; Izumiya, Y; Kumar, A; Uppala, R; Kahlenberg, JM; Liu, FT; Adamopoulos, IE; Wang, EA; Ma, C; Cheng, MY; Xiong, H; Kirane, A; Luxardi, G; Andersen, B; Tsoi, LC; Lebrilla, CB; Gudjonsson, JE; Maverakis, E (22 August 2022). "Biogeographic and disease-specific alterations in epidermal lipid composition and single-cell analysis of acral keratinocytes". JCI Insight. 7 (16). doi:10.1172/jci.insight.159762. PMC 9462509. PMID 35900871.
- ^ Hill JR, Wertz PW (2009). "Structures of the ceramides from porcine palatal stratum corneum". Lipids. 44 (3): 291–295. doi:10.1007/s11745-009-3283-9. PMID 19184160. S2CID 4005575.
- ^ a b Garidel P, Fölting B, Schaller I, Kerth A (2010). "The microstructure of the stratum corneum lipid barrier: mid-infrared spectroscopic studies of hydrated ceramide:palmitic acid:cholesterol model systems". Biophysical Chemistry. 150 (1–3): 144–156. doi:10.1016/j.bpc.2010.03.008. PMID 20457485.
- ^ Elias, Peter (2006). Skin barrier. New York: Taylor & Francis. ISBN 9780824758158.
- ^ a b Feingold KR (2007). "Thematic review series: skin lipids. The role of epidermal lipids in cutaneous permeability barrier homeostasis". Journal of Lipid Research. 48 (12): 2531–2546. doi:10.1194/jlr.R700013-JLR200. PMID 17872588.
- ^ Motta, S; Monti, M; Sesana, S; Caputo, R; Carelli, S; Ghidoni, R (8 September 1993). "Ceramide composition of the psoriatic scale". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1182 (2): 147–51. doi:10.1016/0925-4439(93)90135-n. PMID 8357845.
- ^ Merleev, Alexander A.; Le, Stephanie T.; Alexanian, Claire; Toussi, Atrin; Xie, Yixuan; Marusina, Alina I.; Watkins, Steven M.; Patel, Forum; Billi, Allison C.; Wiedemann, Julie; Izumiya, Yoshihiro; Kumar, Ashish; Uppala, Ranjitha; Kahlenberg, J. Michelle; Liu, Fu-Tong; Adamopoulos, Iannis E.; Wang, Elizabeth A.; Ma, Chelsea; Cheng, Michelle Y.; Xiong, Halani; Kirane, Amanda; Luxardi, Guillaume; Andersen, Bogi; Tsoi, Lam C.; Lebrilla, Carlito B.; Gudjonsson, Johann E.; Maverakis, Emanual (22 August 2022). "Biogeographic and disease-specific alterations in epidermal lipid composition and single-cell analysis of acral keratinocytes". JCI Insight. 7 (16). doi:10.1172/jci.insight.159762. PMC 9462509. PMID 35900871.
- ^ Coderch, Luisa, et al. "Ceramides and skin function." American journal of clinical dermatology 4 (2003): 107-129.
- ^ Yang G, Badeanlou L, Bielawski J, Roberts AJ, Hannun YA, Samad F (2009). "Central role of ceramide biosynthesis in body weight regulation, energy metabolism, and the metabolic syndrome". American Journal of Physiology. 297 (1): E211 – E224. doi:10.1152/ajpendo.91014.2008. PMC 2711669. PMID 19435851.
- ^ Febbraio, Mark (2014). "Role of interleukins in obesity:implications for metabolic disease". Trends in Endocrinology and Metabolism. 25 (6): 312–319. doi:10.1016/j.tem.2014.02.004. PMID 24698032. S2CID 27123917.
- ^ a b c d Bismuth J, Lin P, Yao Q, Chen C (2008). "Ceramide: a common pathway for atherosclerosis?". Atherosclerosis. 196 (2): 497–504. doi:10.1016/j.atherosclerosis.2007.09.018. PMC 2924671. PMID 17963772.
- ^ Whitney P. Bowe; Leon H. Kircik (August 2014). "The Importance of Photoprotection and Moisturization in Treating Acne Vulgaris". Journal of Drugs in Dermatology. 13 (8): 89. Diarsipkan dari versi aslinya tanggal 2022-01-02. Diakses tanggal 2022-01-02.
- ^ "Hydroxypalmitoyl Sphinganine (Explained + Products)". incidecoder.com. Diarsipkan dari versi aslinya tanggal 12 July 2021. Diakses tanggal 12 July 2021.
- ^ Hallahan DE (1996). "Radiation-mediated gene expression in the pathogenesis of the clinical radiation response". Sem. Radiat. Oncol. 6 (4): 250–267. doi:10.1016/S1053-4296(96)80021-X. PMID 10717183.
- ^ Velasco, G; Galve-Roperh, I; Sánchez, C; Blázquez, C; Haro, A; Guzmán, M (2005). "Cannabinoids and ceramide: Two lipids acting hand-by-hand". Life Sciences. 77 (14): 1723–31. doi:10.1016/j.lfs.2005.05.015. PMID 15958274.
- ^ a b Wehbe, Zeinab; Behringer, Sidney; Alatibi, Khaled; Watkins, David; Rosenblatt, David; Spiekerkoetter, Ute; Tucci, Sara (2019-11-01). "The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids (dalam bahasa Inggris). 1864 (11): 1629–1643. doi:10.1016/j.bbalip.2019.07.012. ISSN 1388-1981. PMID 31376476.
- ^ Tucci, Sara (2020-01-22). "Brain metabolism and neurological symptoms in combined malonic and methylmalonic aciduria". Orphanet Journal of Rare Diseases. 15 (1): 27. doi:10.1186/s13023-020-1299-7. ISSN 1750-1172. PMC 6977288. PMID 31969167.
- ^ "Ceramides - Skin Lipids That Keep Skin Moisturized". Diarsipkan dari versi aslinya tanggal 6 April 2016. Diakses tanggal 29 January 2015.
- ^ "Safety Assessment of Ceramides as Used in Cosmetics" (PDF). Cosmetic Ingredient Review. May 16, 2014. Diarsipkan (PDF) dari versi aslinya tanggal January 13, 2021. Diakses tanggal August 26, 2015.
- ^ Huang, WC; Chen, CL; Lin, YS; Lin, CF (2011). "Apoptotic Sphingolipid Ceramide in Cancer Therapy". Journal of Lipids. 2011 (2011): 565316. doi:10.1155/2011/565316. PMC 3066853. PMID 21490804.
- ^ Minamino, Miki; Sakaguchi, Ikuyo; Naka, Takashi; Ikeda, Norikazu; Kato, Yoshiko; Tomiyasu, Ikuko; Yano, Ikuya; Kobayashi, Kazuo (2003). "Bacterial ceramides and sphingophospholipids induce apoptosis of human leukaemic cells". Microbiology. 149 (8): 2071–2081. doi:10.1099/mic.0.25922-0. PMID 12904547.

