Tenofovir alafenamida
Artikel ini memerlukan pemutakhiran informasi. |
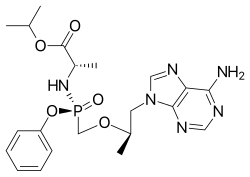
| |
|---|---|
| Nama sistematis (IUPAC) | |
| Isopropil (2S)-2-[[[(1R)-2-(6-aminopurin-9-il)-1-metil-etoksi]metil-fenoksi-fosforil]amino]propanoat | |
| Data klinis | |
| Nama dagang | Vemlidy |
| AHFS/Drugs.com | monograph |
| Data lisensi | US Daily Med:alafenamide pranala |
| Kat. kehamilan | B3(AU) |
| Status hukum | Harus dengan resep dokter (S4) (AU) ℞-only (CA) POM (UK) ℞-only (US) ℞ Preskripsi saja |
| Rute | Oral |
| Data farmakokinetik | |
| Ikatan protein | ~80%[1] |
| Waktu paruh | 0,51 jam |
| Ekskresi | Feses (31,7%), urin (<1%) |
| Pengenal | |
| Nomor CAS | 379270-37-8 |
| Kode ATC | J05AF13 Kode kombinasi: J05AR17 J05AR18 J05AR19 J05AR20 J05AR22 |
| PubChem | CID 9574768 |
| DrugBank | DB09299 |
| ChemSpider | 7849225 |
| UNII | EL9943AG5J |
| KEGG | D10428 |
| ChEBI | CHEBI:90926 |
| ChEMBL | CHEMBL2107825 |
| Sinonim | GS-7340 |
| Data kimia | |
| Rumus | C21H29N6O5P |
| |

Tenofovir alafenamida adalah obat antivirus yang digunakan untuk melawan hepatitis B dan HIV. Obat ini digunakan untuk mengobati infeksi virus hepatitis B kronis (HBV) pada orang dewasa dengan penyakit hati yang terkompensasi[2] dan diberikan dalam kombinasi dengan obat lain untuk pencegahan dan pengobatan HIV. Obat ini diminum.[1]
Tenofovir alafenamida adalah penghambat transkriptase balik nukleotida dan merupakan bakal obat dari tenofovir. Obat ini dikembangkan oleh Gilead Sciences berdasarkan teknologi protein milik Chris McGuigan dan diaplikasikan dalam bentuk tenofovir alafenamida fumarat (TAF). Terkait erat dengan penghambat transkriptase balik yang umum digunakan yakni tenofovir disoproksil fumarat (TDF), TAF memiliki aktivitas antivirus yang lebih besar dan distribusi yang lebih baik ke dalam jaringan limfoid daripada obat tersebut.[3][4] Obat ini disetujui untuk digunakan di AS untuk HIV pada tahun 2015,[5] dan untuk hepatitis B pada tahun 2016.[6]
Obat kombinasi yang mengandung tenofovir alafenamida
- Elvitegravir/kobisistat/emtrisitabin/tenofovir alafenamida[7] — disetujui di Amerika Serikat dan Uni Eropa pada bulan November 2015,[8][9][10][11] (bandingkan dengan elvitegravir/kobisistat/emtrisitabin/tenofovir[12][13][14][15])
- Emtrisitabin/rilpivirin/tenofovir alafenamida[16] — disetujui di Amerika Serikat pada bulan Maret 2016, dan di Uni Eropa pada bulan Juni 2016,[17][18][19] (bandingkan dengan emtrisitabin/rilpivirin/tenofovir[20][21][22])
- Emtrisitabin/tenofovir alafenamida[23] — disetujui di Amerika Serikat pada bulan April 2016 (bandingkan dengan emtrisitabin/tenofovir disoproksil). Pada bulan Oktober 2019, disetujui di Amerika Serikat untuk profilaksis prapajanan HIV-1 (PrEP).[24][25]
- Biktegravir/emtrisitabin/tenofovir alafenamida[26] — disetujui di Amerika Serikat pada bulan Februari 2018.
- Darunavir/kobisistat/emtrisitabin/tenofovir alafenamida[27] — disetujui di Uni Eropa pada bulan September 2017, di Amerika Serikat pada bulan Juli 2018, dan di Australia pada bulan November 2019.[28][29][30][31][32]
- Dolutegravir/emtrisitabin/tenofovir alafenamida.[33]
- Dolutegravir/lamivudin/tenofovir alafenamida.[34][35]
Penelitian
Gilead mengumumkan uji klinis Fase III yang mengevaluasi regimen tablet tunggal yang menggabungkan tenofovir alafenamida dengan kobisistat, emtrisitabin, dan elvitegravir[36] dan mengembangkan koformulasi obat dengan kobisistat, emtrisitabin, dan penghambat protease darunavir.[37][38][39] Dalam studi selama 48 minggu yang membandingkan elvitegravir/kobisistat/emtrisitabin/tenofovir disoproksil dengan elvitegravir/kobisistat/emtrisitabin/tenofovir alafenamida, hasilnya menunjukkan efek obat yang lebih baru tidak kalah dengan agen yang sudah ada, tetapi pada dosis yang jauh lebih rendah dan dengan insiden efek samping yang lebih rendah seperti gangguan fungsi ginjal.[40][41][42] FDA menyetujui regimen pengobatan berbasis TAF untuk pengobatan HIV-1 pada bulan November 2015. Genvoya adalah rejimen berbasis TAF pertama yang menerima persetujuan.[5]
Referensi
- ^ a b "Vemlidy- tenofovir alafenamide tablet". DailyMed. U.S. National Library of Medicine. 11 February 2020. Diarsipkan dari versi aslinya tanggal 9 July 2021. Diakses tanggal 18 April 2020.
- ^ Childs-Kean LM, Egelund EF, Jourjy J (October 2018). "Tenofovir Alafenamide for the Treatment of Chronic Hepatitis B Monoinfection". Pharmacotherapy. 38 (10): 1051–1057. doi:10.1002/phar.2174. PMID 30120841. S2CID 52033420.
- ^ Eisenberg EJ, He GX, Lee WA (2001). "Metabolism of GS-7340, a novel phenyl monophosphoramidate intracellular prodrug of PMPA, in blood". Nucleosides Nucleotides Nucleic Acids. 20 (4–7): 1091–8. doi:10.1081/NCN-100002496. PMID 11562963. S2CID 24652157.
- ^ Markowitz M, Zolopa A, Ruane P, Squires K, Zhong L, Kearney BP, Lee W (March 2011). GS-7340 demonstrates greater declines in HIV-1 RNA than tenofovir disoproxil fumarate during 14 days of monotherapy in HIV-1 infected subjects (PDF). 18th Conference on Retroviruses and Opportunistic Infections. Diarsipkan dari asli (PDF) tanggal 25 April 2012.
- ^ a b "U.S. Food and Drug Administration Approves Gilead's Single Tablet Regimen Genvoya (Elvitegravir, Cobicistat, Emtricitabine and Tenofovir Alafenamide) for Treatment of HIV-1 Infection" (Press release). Gilead. 5 November 2015. Diarsipkan dari asli tanggal 8 November 2015.
- ^ "FDA Approves Vemlidy (tenofovir alafenamide) for Chronic Hepatitis B in Adults". United States Department of Health and Human Services. 21 November 2016. Diarsipkan dari versi aslinya tanggal 11 October 2019. Diakses tanggal 11 October 2019.
- ^ "Genvoya- elvitegravir, cobicistat, emtricitabine, and tenofovir alafenamide tablet". DailyMed. U.S. National Library of Medicine. 11 February 2019. Diarsipkan dari versi aslinya tanggal 1 August 2020. Diakses tanggal 18 April 2020.
- ^ "Genvoya (elvitegravir, cobicistat, emtricitabine, and tenofovir alafenamide) fixed-dose combination tablet". U.S. Food and Drug Administration (FDA). 8 December 2015. Diarsipkan dari versi aslinya tanggal 29 July 2020. Diakses tanggal 28 July 2020.
- ^ "Summary Review: Genvoya" (PDF). US Food and Drug Administration. 6 August 2012. Diarsipkan (PDF) dari versi aslinya tanggal 29 July 2020. Diakses tanggal 29 July 2020.
- ^ "Genvoya EPAR". European Medicines Agency (EMA). 17 September 2018. Diarsipkan dari versi aslinya tanggal 8 August 2020. Diakses tanggal 28 July 2020.
- ^ "Health Canada New Drug Authorizations: 2015 Highlights". Health Canada. 4 May 2016. Diakses tanggal 7 April 2024.
- ^ "Drug Approval Package: Stribild (elvitegravir, cobicistat, emtricitabine, tenofovir disoproxil fumarate) Fixed Dose". U.S. Food and Drug Administration (FDA). 10 October 2012. Diarsipkan dari versi aslinya tanggal 29 July 2020. Diakses tanggal 28 July 2020.
- ^ "Summary Review: Stribild" (PDF). US Food and Drug Administration. 19 October 2015. Diarsipkan (PDF) dari versi aslinya tanggal 29 July 2020. Diakses tanggal 29 July 2020.
- ^ "Stribild- elvitegravir, cobicistat, emtricitabine, and tenofovir disoproxil fumarate tablet, film coated". DailyMed. U.S. National Library of Medicine. 28 January 2019. Diarsipkan dari versi aslinya tanggal 29 July 2020. Diakses tanggal 28 July 2020.
- ^ "Stribild EPAR". European Medicines Agency (EMA). 17 September 2018. Diarsipkan dari versi aslinya tanggal 29 July 2020. Diakses tanggal 28 July 2020.
- ^ "Odefsey- emtricitabine, rilpivirine hydrochloride, and tenofovir alafenamide tablet". DailyMed. U.S. National Library of Medicine. 6 December 2019. Diarsipkan dari versi aslinya tanggal 1 August 2020. Diakses tanggal 18 April 2020.
- ^ "Odefsey (emtricitabine, rilpivirine, and tenofovir alafenamide) Tablets". U.S. Food and Drug Administration (FDA). 29 November 2016. Diarsipkan dari versi aslinya tanggal 13 April 2021. Diakses tanggal 28 July 2020.
- ^ "Odefsey EPAR". European Medicines Agency (EMA). 17 September 2018. Diarsipkan dari versi aslinya tanggal 29 July 2020. Diakses tanggal 28 July 2020.
- ^ "Immune system health". Health Canada. 9 May 2018. Diakses tanggal 13 April 2024.
- ^ "Drug Approval Package: (emtricitabine/rilpivirine/tenofovir disoproxil fumarate) NDA #202123". U.S. Food and Drug Administration (FDA). 6 September 2012. Diarsipkan dari versi aslinya tanggal 29 July 2020. Diakses tanggal 28 July 2020.
- ^ "Summary Review: Complera" (PDF). US Food and Drug Administration. 19 July 2011. Diarsipkan (PDF) dari versi aslinya tanggal 1 April 2021. Diakses tanggal 29 July 2020.
- ^ "Complera- emtricitabine, rilpivirine hydrochloride, and tenofovir disoproxil fumarate tablet, film coated". DailyMed. U.S. National Library of Medicine. 9 December 2019. Diarsipkan dari versi aslinya tanggal 29 July 2020. Diakses tanggal 28 July 2020.
- ^ "Descovy- emtricitabine and tenofovir alafenamide tablet". DailyMed. U.S. National Library of Medicine. 13 January 2020. Diarsipkan dari versi aslinya tanggal 24 June 2021. Diakses tanggal 18 April 2020.
- ^ "FDA approves second drug to prevent HIV infection as part of ongoing efforts to end the HIV epidemic". U.S. Food and Drug Administration (FDA). 3 October 2019. Diarsipkan dari versi aslinya tanggal 11 October 2019. Diakses tanggal 11 October 2019.
- ^ Mandavilli A (4 October 2019). "F.D.A. Approves New H.I.V.-Prevention Drug, but Not for Everyone". The New York Times. Diarsipkan dari versi aslinya tanggal 9 July 2021. Diakses tanggal 11 October 2019.
- ^ "Biktarvy- bictegravir sodium, emtricitabine, and tenofovir alafenamide fumarate tablet". DailyMed. U.S. National Library of Medicine. 8 August 2019. Diarsipkan dari versi aslinya tanggal 1 August 2020. Diakses tanggal 18 April 2020.
- ^ "Symtuza- darunavir, cobicistat, emtricitabine, and tenofovir alafenamide tablet, film coated". DailyMed. U.S. National Library of Medicine. 6 March 2020. Diarsipkan dari versi aslinya tanggal 9 July 2021. Diakses tanggal 18 April 2020.
- ^ "Drug Approval Package: Symtuza (darunavir, cobicistat, emtricitabine, and tenofovir alafenamide)". U.S. Food and Drug Administration (FDA). 11 December 2018. Diarsipkan dari versi aslinya tanggal 9 July 2021. Diakses tanggal 19 August 2020.
- ^ "Symtuza EPAR". European Medicines Agency. 17 September 2018. Diarsipkan dari versi aslinya tanggal 10 July 2021. Diakses tanggal 19 August 2020.
- ^ "TGA eBS - Product and Consumer Medicine Information Licence". Diarsipkan dari versi aslinya tanggal 20 February 2022. Diakses tanggal 20 February 2022.
- ^ "Symtuza 800/150/200/10 Tablets". NPS MedicineWise. 15 July 2021. Diarsipkan dari versi aslinya tanggal 20 February 2022. Diakses tanggal 19 February 2022.
- ^ "Drug and medical device highlights 2018: Helping you maintain and improve your health". Health Canada. 14 October 2020. Diakses tanggal 17 April 2024.
- ^ "Drugs@FDA: FDA-Approved Drugs". U.S. Food and Drug Administration (FDA). Diarsipkan dari versi aslinya tanggal 9 July 2021. Diakses tanggal 5 December 2020.
- ^ "Drugs@FDA: FDA-Approved Drugs". accessdata.fda.gov. Diarsipkan dari versi aslinya tanggal 2 April 2022. Diakses tanggal 2 April 2022.
- ^ "Tentative Approval: Dolutegravir, Lamivudine, and Tenofovir Alafenamide Tablets" (PDF). US Food and Drug Administration. 30 March 2022. Diarsipkan (PDF) dari versi aslinya tanggal 7 May 2022. Diakses tanggal 2 April 2022.
- ^ "Gilead Initiates Phase 3 Clinical Program for Tenofovir Alafenamide, a Novel Low-Dose Prodrug for the Treatment of HIV" (Press release). Gilead. 24 January 2013. Diarsipkan dari versi aslinya tanggal 11 October 2019.
- ^ "Gilead Sciences Finalizes Agreement with Tibotec Pharmaceuticals to Develop and Commercialize a Single-Tablet Regimen of Prezista with Emtriva, GS 7340 and Cobicistat". Gilead Sciences (Press release). 15 November 2011. Diarsipkan dari versi aslinya tanggal 11 October 2019. Diakses tanggal 10 October 2019.
- ^ Horn T (15 March 2012). "GS-7340 Packs Greater HIV Punch, Potentially Better Safety, Versus Viread". AIDSmeds.com. Diarsipkan dari asli tanggal 8 September 2015.
- ^ "Pharmacokinetics of a Novel EVG/COBI/FTC/GS-7340 Single Tablet Regimen". 13th International Workshop on Clinical Pharmacology of HIV Therapy. Barcelona, Spain. April 2012. Diarsipkan dari asli tanggal 28 November 2020.
- ^ "Once-Daily Tenofovir Prodrug Combo Pill as Effective as Stribild". AIDSmeds. 1 November 2012. Diarsipkan dari asli tanggal 20 September 2015.
- ^ Highleyman, Liz (6 March 2013). "CROI 2013: New Pro-drug Tenofovir Alafenamide Appears Equally Effective but Better Tolerated". hivandhepatitis.com. Diarsipkan dari asli tanggal 25 October 2020. Diakses tanggal 25 July 2024.
- ^ Horn T (13 June 2013). "Tenefovir Alafenamide Fumarate (TAF) Sign-On Letter to Gilead". Treatment Action Group. Diarsipkan dari asli tanggal 19 November 2019.

