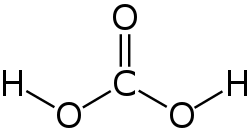
Asam karbonat
| |
| |
| Nama | |
|---|---|
| Nama IUPAC
Asam karbonat[1]
| |
Nama lain
| |
| Penanda | |
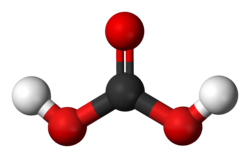
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Nomor EC | |
| Referensi Gmelin | 25554 |
| KEGG | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| H2CO3 | |
| Penampilan | Gas nirwarna |
| Titik lebur | −53 °C (−63 °F; 220 K)[3] (menyublim) |
| Titik didih | 127 °C (261 °F; 400 K) (terdekomposisi) |
| Bereaksi membentuk karbon dioksida dan air | |
| Keasaman (pKa) | |
| Basa konjugat | Bikarbonat, karbonat |
| Bahaya | |
| Struktur | |
| monoklinik | |
| p21/c, No. 14 | |
| - | |
a = 5,392 Å, b = 6,661 Å, c = 5,690 Å α = 90°, β = 92,66°, γ = 90°[4] (D2CO3 pada 1,85 GPa, 298 K)
| |
Volum kisi (V)
|
204.12 Å3 |
Satuan formula (Z)
|
4 formula per sel |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Asam karbonat adalah asam organik dengan rumus kimia H2CO3. Asam karbonat termasuk asam lemah. Dalam fisiologi, asam karbonat digambarkan sebagai asam volatil atau asam pernapasan, karena senyawa ini adalah satu-satunya asam yang diekskresikan sebagai gas oleh paru-paru.[5] Senyawa ini memainkan peran penting dalam sistem penyangga bikarbonat untuk mempertahankan homeostasis asam-basa.
Sudah lama diyakini bahwa asam karbonat tidak dapat hadir sebagai senyawa murninya. Namun, pada tahun 1991 dilaporkan bahwa para ilmuwan NASA telah berhasil membuat sampel H2CO3 padat.[6]
Kesetimbangan reaksi kimia
Ketika karbon dioksida (CO2) larut dalam air (H2O) maka akan menghasilkan asam karbonat:[7]
- CO2 + H2O ⇌ H2CO3.
Asam karbonat bisa berubah menjadi ion bikarbonat (HCO3-) dan atom hidrogen.
Keasaman
Asam karbonat adalah asam karboksilat dengan gugus hidroksil sebagai substituen. Senyawa ini juga merupakan asam poliprotik - khususnya diprotik, artinya senyawa ini memiliki dua proton yang dapat terlepas dari molekul induknya. Sehingga, terdapat dua konstanta disosiasi, yang pertama adalah untuk disosiasi menjadi ion bikarbonat (juga disebut hidrogen karbonat) HCO3−:
- Ka1 = 2.5×10−4;[7] pKa1 = 3.6 pada 25 °C.
Harus diperhatikan saat mengutip dan menggunakan konstanta disosiasi pertama asam karbonat. Dalam larutan air, asam karbonat ada dalam kesetimbangan dengan karbon dioksida, dan konsentrasi H2CO3 auh lebih rendah daripada konsentrasi CO2. Dalam banyak analisis, H2CO3 memasukkan CO2 terlarut (dirujuk sebagai CO2(aq)), H2CO3* digunakan untuk mewakili kedua spesi saat menulis persamaan kesetimbangan kimia berair. Persamaan dapat ditulis ulang sebagai berikut:[7]
- H2CO3* ⇌ HCO3− + H+
- Ka(app) = 4.47×10−7; pK(app) = 6.35 pada 25 °C dan kekuatan ionik = 0.0.
Peranan asam karbonat dalam darah
Asam karbonat merupakan langkah intermediat dalam transpor CO2 ke luar dari tubuh melalui pertukaran gas secara pernapasan. Reaksi hidrasi CO2 umumnya sangat lambat tanpa adanya katalis, tetapi sel darah merah mengandung enzim karbonik anhidrase, yang dapat meningkatkan laju reaksi serta mendisosiasi ion hidrogen (H+) dari asam karbonat yang terbentuk, menghasilkan bikarbonat (HCO3−) yang larut dalam plasma darah. Reaksi yang terkatalisasi ini berbalik di paru-paru, di mana bikarbonat diubah kembali menjadi CO2 sehingga gas ini dapat dibuang ke luar. Keseimbangan ini berperan penting sebagai suatu larutan penyangga atau buffer dalam darah mamalia.[8] Sebuah laporan teori pada tahun 2016 menunjukkan bahwa asam karbonat dapat memainkan peran penting dalam melindungi berbagai basa nitrogen dalam serum darah.[9]
Lihat pula
- Air berkarbonasi (minuman ringan)
- Karbon dioksida
- Dihidroksimetilidena (asam karbonat)
- Asam nonvolatil
- Pengasaman laut
Referensi
- ^ "Front Matter". Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. hlm. P001–4. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c Perrin, D. D., ed. (1982) [1969]. Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution. IUPAC Chemical Data (Edisi 2). Oxford: Pergamon (dipublikasikan 1984). "Carbonic Acid, H2CO3" entry. ISBN 0-08-029214-3. LCCN 82-16524.
- ^ W. Hage, K. R. Liedl; Liedl, E.; Hallbrucker, A; Mayer, E (1998). "Carbonic Acid in the Gas Phase and Its Astrophysical Relevance". Science. 279 (5355): 1332–5. Bibcode:1998Sci...279.1332H. doi:10.1126/science.279.5355.1332. PMID 9478889.
- ^ Benz, Sebastian; Chen, Da; Möller, Andreas; Hofmann, Michael; Schnieders, David; Dronskowski, Richard (September 2022). "The Crystal Structure of Carbonic Acid". Inorganics (dalam bahasa Inggris). 10 (9): 132. doi:10.3390/inorganics10090132. ISSN 2304-6740.
- ^ Acid-Base Physiology 2.1 – Acid-Base Balance oleh Kerry Brandis.
- ^ M. H. Moore; R. K. Khanna (1990). "Infrared and mass spectral studies of proton irradiated H2O + CO2 ice: Evidence for carbonic acid". Spectrochimica Acta Part A. 47 (2): 255–262. Bibcode:1991AcSpA..47..255M. doi:10.1016/0584-8539(91)80097-3.
- ^ a b c Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (Edisi 2), Oxford: Butterworth-Heinemann, hlm. 310, ISBN 0-7506-3365-4 Pemeliharaan CS1: Banyak nama: authors list (link)
- ^ "excretion". Encyclopædia Britannica. Encyclopædia Britannica Ultimate Reference Suite. Chicago: Encyclopædia Britannica, 2010.
- ^ "Reaction Mechanism for Direct Proton Transfer from Carbonic Acid to a Strong Base in Aqueous Solution I: Acid and Base Coordinate and Charge Dynamics", S. Daschakraborty, P. M. Kiefer, Y. Miller, Y. Motro, D. Pines, E. Pines, and J. T. Hynes. J. Phys. Chem. B (2016), 120, 2271.
Bacaan lebih lanjut
 "Climate and Carbonic Acid" di Popular Science Monthly Volume 59, July 1901
"Climate and Carbonic Acid" di Popular Science Monthly Volume 59, July 1901
- Welch, M. J.; Lifton, J. F.; Seck, J. A. (1969). "Tracer studies with radioactive oxygen-15. Exchange between carbon dioxide and water". J. Phys. Chem. 73 (335): 3351. doi:10.1021/j100844a033.
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd Edn.). New York: McGraw-Hill. ISBN 978-0-07-112651-9.
- Moore, M. H.; Khanna, R. (1991). "Infrared and Mass Spectral Studies of Proton Irradiated H2O+Co2 Ice: Evidence for Carbonic Acid Ice: Evidence for Carbonic Acid". Spectrochimica Acta. 47A (2): 255–262. Bibcode:1991AcSpA..47..255M. doi:10.1016/0584-8539(91)80097-3.
- W. Hage, K. R. Liedl; Liedl, E.; Hallbrucker, A; Mayer, E (1998). "Carbonic Acid in the Gas Phase and Its Astrophysical Relevance". Science. 279 (5355): 1332–1335. Bibcode:1998Sci...279.1332H. doi:10.1126/science.279.5355.1332. PMID 9478889.
- Hage, W.; Hallbrucker, A.; Mayer, E. (1995). "A Polymorph of Carbonic Acid and Its Possible Astrophysical Relevance". J. Chem. Soc. Faraday Trans. 91 (17): 2823–2826. doi:10.1039/ft9959102823.
Pranala luar
- (Inggris) Ask a Scientist: Carbonic Acid Decomposition Diarsipkan 2010-11-21 di Wayback Machine.
- (Inggris) Why was the existence of carbonic acid unfairly doubted for so long?
- (Inggris) Carbonic acid/bicarbonate/carbonate equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet
- (Inggris) How to calculate concentration of Carbonic Acid in Water


