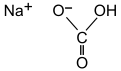
Natrium bikarbonat
| |||
| |||
 | |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
natrium hidrogenkarbonat
| |||
| Nama lain | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Referensi Beilstein | 4153970 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Nomor EC | |||
| KEGG | |||
| MeSH | Sodium+bicarbonate | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| NaHCO3 | |||
| Massa molar | 84,0066 g mol−1 | ||
| Penampilan | Kristal putih | ||
| Bau | Tak berbau | ||
| Densitas |
| ||
| Titik lebur | (Terurai menjadi natrium karbonat mulai dari 50 °C[1][6]) | ||
| Kelarutan | 0,02 wt% aseton, 2,13 wt% metanol @22 °C.[4] tidak larut dalam etanol | ||
| log P | −0,82 | ||
| Keasaman (pKa) | |||
| Indeks bias (nD) | nα = 1,377 nβ = 1,501 nγ = 1,583 | ||
| Struktur | |||
| Monoklinik | |||
| Termokimia | |||
| Kapasitas kalor (C) | 87,6 J/mol K[7] | ||
| Entropi molar standar (S |
101,7 J/mol K[7] | ||
| Entalpi pembentukan standar (ΔfH |
−950,8 kJ/mol[7] | ||
| Energi bebas Gibbs (ΔfG) | −851,0 kJ/mol[7] | ||
| Farmakologi | |||
| Kode ATC | B05 B05XA02, QG04BQ01 | ||
| Rute administrasi |
Intravena, oral | ||
| Bahaya | |||
| Bahaya utama | Menyebabkan iritasi mata yang serius | ||
| Lembar data keselamatan | External MSDS | ||
| Titik nyala | Tahan api | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
4220 mg/kg (pada tikus, secara oral)[8] | ||
| Senyawa terkait | |||
Anion lain
|
Natrium karbonat | ||
Kation lainnya
|
|||
Senyawa terkait
|
|||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||

Natrium bikarbonat atau soda kue (bahasa Inggris: baking soda) adalah senyawa kimia dengan rumus NaHCO3. Dalam penyebutannya kerap disingkat menjadi bicnat atau bicarb. Senyawa ini termasuk kelompok garam dan telah digunakan sejak lama (abad 19).[9]
Senyawa ini merupakan kristal yang sering terdapat dalam bentuk serbuk. Natrium bikarbonat larut dalam air. Senyawa ini digunakan dalam roti atau kue karena bereaksi dengan bahan lain membentuk gas karbon dioksida, yang menyebabkan roti "mengembang".[9]
Senyawa ini juga digunakan sebagai obat antasid (penyakit maag atau tukak lambung). Karena bersifat alkaloid (basa), senyawa ini juga digunakan sebagai obat penetral asam bagi penderita asidosis tubulus renalis (ATR) atau rhenal tubular acidosis (RTA). Selain itu, natrium bikarbonat juga dapat dimanfaatkan untuk menurunkan kadar asam urat.[10]
NaHCO3 umumnya diproduksi melalui proses Solvay, yang memerlukan reaksi natrium klorida, amonia, dan karbon dioksida dalam air. NaHCO3 diproduksi sebanyak 100 000 ton/tahun (2001).[11]
Soda kue juga diproduksi secara komesial dari soda abu (diperoleh melalui penambangan bijih trona, yang dilarutkan dalam air lalu direaksikan dengan karbon dioksida. Lalu NaHCO3 mengendap sesuai persamaan berikut:
- Na2CO3 + CO2 + H2O → 2 NaHCO3
Pada masakan
Senyawa ini bermanfaat dalam mengembangkan produk roti, kue dan biskuit tanpa proses peragian. Soda kue dapat bereaksi dengan pemanasan (masak) dan dengan zat asam. Soda kue hanya cocok ditambahkan pada makanan yang juga menambahkan asam/zat pH rendah pada adonannya seperti pada butter milk, yogurt, cokelat, air jeruk, atau cuka. Jika pada adonan kue atau roti tersebut menggunakan soda kue tanpa zat asam, maka akan bertambah sedikit rasa pahit logam, rasa sabun, dan sedikit berwarna kuning disebabkan menghasilkan zat Natrium Karbonat (Na2CO3).
Reaksi kimia saat pemanasan larutan baking soda tanpa zat asam yang mengeluarkan gas CO2 di atas suhu 80 °C (180 °F):
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Sedangkan reaksi kimia larutan baking soda dengan zat asam:
- NaHCO3 + H+ → Na+ + CO2 + H2O
Jika dalam adonan roti atau kue tidak mengandung zat asam atau sedikit asam maka soda kue dapat diganti dengan bubuk pengembang. Bubuk pengembang adalah soda kue yang sudah ditambah dengan zat asam tambahan, zat penstabil, serta zat lain guna memaksimalkan proses memasak, tanpa meninggalkan rasa sedikit rasa pahit logam, rasa sabun, dan sedikit berwarna kuning.
Saat menambahkan asam, bahan alkali seperti susu murni atau cokelat sering ditambahkan ke makanan panggang untuk menghindari rasa asam berlebih dari asam yang ditambahkan.
Referensi
- ^ a b Haynes, p. 4,90
- ^ a b c Haynes, p. 5.194
- ^ a b c "Sodium Bicarbonate" (PDF). United Nations Environment Programme. Diarsipkan dari asli (PDF) tanggal 16 May 2011.
- ^ Ellingboe JL, Runnels JH (1966). "Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures". J. Chem. Eng. Data. 11 (3): 323–324. doi:10.1021/je60030a009.
- ^ a b Haynes, p. 7,23
- ^ Pasquali I, Bettini R, Giordano F (2007). "Thermal behaviour of diclofenac, diclofenac sodium and sodium bicarbonate compositions". Journal of Thermal Analysis and Calorimetry. 90 (3): 903–907. doi:10.1007/s10973-006-8182-1. S2CID 95695262.
- ^ a b c d Haynes, p. 5,19
- ^ Griffith, John F. (1964). "Interlaboratory variations in the determination of acute oral LD50". Toxicology and Applied Pharmacology. 6 (6): 726–730. doi:10.1016/0041-008X(64)90124-3. PMID 14235840.
- ^ a b Praja, Denny Indra (2015-09-01). Zat Aditif Makanan: Manfaat dan Bahayanya. Garudhawaca. ISBN 978-602-7949-55-3.
- ^ "Salinan arsip". Diarsipkan dari asli tanggal 2013-04-04. Diakses tanggal 2013-04-06.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.





