Talium(I) iodida
| |
| Nama | |
|---|---|
| Nama lain
Talium monoiodida
Talo iodida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| TlI | |
| Massa molar | 331,287 g/mol[1] |
| Penampilan | Kristal kuning[1] |
| Densitas | 7,1 g/cm3[1] |
| Titik lebur | 441,7 °C (827,1 °F; 714,8 K)[1] |
| Titik didih | 824 °C (1.515 °F; 1.097 K)[1] |
| 0,085 g/L (25 °C)[1] | |
| Kelarutan | Tak larut dalam alkohol[1] |
| −82,2·10−6 cm3/mol[2] | |
| Bahaya | |
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H300, H330, H373, H411 | |
| P260, P264, P270, P271, P273, P284, P301+310, P304+340, P310, P314, P320, P321, P330, P391, P403+233, P405, P501 | |
| Titik nyala | Tak mudah terbakar |
| Senyawa terkait | |
Anion lain
|
Talium(I) fluorida Talium(I) klorida Talium(I) bromida |
Kation lainnya
|
Galium(I) iodida Indium(I) iodida |
Senyawa terkait
|
Raksa(II) iodida Timbal(II) iodida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Talium(I) iodida adalah sebuah senyawa anorganik dengan rumus TlI. Senyawa ini tidaklah biasa karena merupakan salah satu dari beberapa iodida logam yang tak larut dalam air, bersama dengan AgI, CuI, SnI2, SnI4, PbI2, dan HgI2.
Kimia
TlI dapat dibentuk dalam larutan berair melalui metatesis garam talium yang dapat larut dengan ion iodida. Ia juga terbentuk sebagai produk sampingan dalam iodinasi fenol yang dipromosikan talium dengan talium(I) asetat.
Upaya untuk mengoksidasi TlI menjadi talium(III) iodida gagal dilakukan, karena oksidasi TlI akan menghasilkan talium(I) triiodida, Tl+I3−.
Sifat fisik
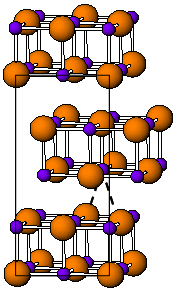
Pada suhu kamar, TlI memiliki warna kuning dan struktur ortorombik[3] yang dapat dianggap sebagai struktur NaCl yang terdistorsi. Struktur yang terdistorsi ini diyakini disebabkan oleh interaksi talium–talium yang menguntungkan, dengan jarak Tl–Tl terdekat adalah 383 pm.[4] Pada suhu 175 °C, bentuk kuning akan berubah menjadi bentuk CsCl berwarna merah. Transisi fase ini disertai dengan lonjakan konduktivitas listrik sekitar dua kali lipat. Struktur CsI dapat distabilkan hingga suhu kamar dengan mendoping TlI dengan halida logam lain seperti RbI, CsI, KI, AgI, TlBr, dan TlCl.[5] Dengan demikian, keberadaan pengotor mungkin bertanggung jawab atas koeksistensi fase TlI kubik dan ortorombik pada kondisi sekitar.[3] Di bawah tekanan tinggi, 160 kbar, TlI akan menjadi konduktor metalik. Film TlI setipis beberapa nanometer yang ditumbuhkan pada substrat LiF, NaCl, atau KBr menunjukkan struktur garam batu kubik.[6]
Aplikasi
Pada awalnya, talium(I) iodida ditambahkan pada lampu busur raksa untuk meningkatkan kinerjanya.[7] Cahaya yang dihasilkan utamanya berada pada bagian hijau-biru dari spektrum cahaya tampak yang paling sedikit diserap oleh air, sehingga lampu ini telah digunakan untuk penerangan bawah air.[8] Di zaman modern, senyawa ini ditambahkan pada lampu halida logam keramik dan kuarsa yang menggunakan senyawa halida tanah jarang seperti disprosium, untuk meningkatkan efisiensinya dan mendapatkan warna cahaya yang lebih mendekati lokus benda hitam. Talium iodida sendiri dapat digunakan untuk menghasilkan lampu halida logam berwarna hijau. Talium(I) iodida juga digunakan dalam jumlah kecil dengan NaI atau CsI untuk menghasilkan sintilator yang digunakan dalam detektor radiasi.
Kemunculan alami
Talium(I) iodida pertama kali ditemukan dalam keadaan alami pada tahun 2017 sebagai poliwujud ortorombik yang disebut mineral nataliyamalikit. Butiran-butiran kecil ditemukan tertanam dalam maskagnit yang bersumber dari fumarol di Avachinsky, sebuah gunung berapi di Semenanjung Kamchatka, Rusia yang dapat mencapai suhu 640 °C (1.184 °F). Para ahli geologi yang menemukannya berspekulasi bahwa penelitian lebih lanjut mengenai mineral ini kemungkinan akan menambah pemahaman mengenai evolusi geokimia planet ini.[9][10]
Keselamatan
Seperti semua senyawa talium, talium(I) iodida sangatlah beracun.
Referensi
- ^ a b c d e f g Haynes, hlm. 4.94
- ^ Haynes, hlm. 4.136
- ^ a b Lowndes, R. P.; Perry, C. H. (1973). "Molecular structure and anharmonicity in thallium iodide". The Journal of Chemical Physics. 58 (1): 271–278. Bibcode:1973JChPh..58..271L. doi:10.1063/1.1678917.
- ^ Mudring, Anja-Verena (2007). "Thallium Halides – New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements". European Journal of Inorganic Chemistry. 2007 (6): 882–890. doi:10.1002/ejic.200600975.
- ^ Sultana, Saima; Rafiuddin (2009). "Electrical conductivity in TlI–TiO2 composite solid electrolyte". Physica B: Condensed Matter. 404 (1): 36–40. Bibcode:2009PhyB..404...36S. doi:10.1016/j.physb.2008.10.002.
- ^ Schulz, L. G. (1951). "Polymorphism of cesium and thallium halides". Acta Crystallographica. 4 (6): 487–489. doi:10.1107/S0365110X51001641.
- ^ Reiling, Gilbert H. (1964). "Characteristics of Mercury Vapor–Metallic Iodide Arc Lamps". Journal of the Optical Society of America. 54 (4): 532. Bibcode:1964JOSA...54..532R. doi:10.1364/JOSA.54.000532.
- ^ Underwater Journal and information bulletin, IPC Science and Technology Press, (1973), hlm. 245
- ^ "Nataliyamalikite: Mineral information, data and localities". www.mindat.org.
- ^ Anderson, Natali (6 Juli 2017). "New Mineral Discovered: Nataliyamalikite". Sci News. Diakses tanggal 7 Februari 2024.
Sumber terkutip
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (Edisi 92). Boca Raton, FL: CRC Press. ISBN 1439855110.

