Asam alkanoat
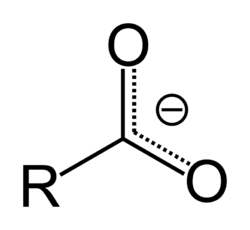

Asam alkanoat (atau asam karboksilat) adalah golongan asam organik alifatik yang memiliki gugus karboksil (biasa dilambangkan dengan −COOH).[1] Semua asam alkanoat adalah asam lemah.[1] Dalam pelarut air, sebagian molekulnya terionisasi dengan melepas atom hidrogen menjadi ion H+.
Asam karboksilat dengan banyak atom karbon (berantai banyak) lebih umum disebut sebagai asam lemak karena sifat-sifat fisiknya.
Sifat fisik
Kelarutan

Asam karboksilat bersifat polar. Asam karboksilat rantai kecil (1 sampai 5 karbon) dapat larut dalam air, sedangkan pada rantai yang lebih panjang semakin kurang larut karena sifat hidrofobik dari rantai alkil. Asam karboksilat untuk rantai yang lebih panjang cenderung larut pada pelarut yang kurang polar seperti eter dan alkohol.[2]
Titik didih
Asam karboksilat cenderung memiliki titik didih yang lebih tinggi daripada air. Hal ini disebabkan oleh luas permukaannya yang besar serta kecenderungan molekulnya membentuk dimer yang stabil.[1]
Keasaman
Asam karboksilat termasuk dalam kelompok asam lemah, yang artinya hanya terdisosiasi sebagian menjadi kation H+ dan anion RCOO– dalam larutan. Sebagai contoh, pada suhu ruangan, 1 molar asam asetat hanya terdisosiasi 0,4% saja. Adanya substituen elektronegatif (seperti halogen) menambah sifat keasaman.
| Asam karboksilat[3] | pKa |
|---|---|
| Asam format (HCOOH) | 3,75 |
| Asam asetat (CH3COOH) | 4,76 |
| Asam kloroasetat (CH2ClCO2H) | 2,86 |
| Asam dikloroasetat (CHCl2CO2H) | 1,29 |
| Asam trikloroasetat (CCl3CO2H) | 0,65 |
| Asam trifluoroasetat (CF3CO2H) | 0,5 |
| Asam oksalat (HO2CCO2H) | 1,27 |
| Asam benzoat (C6H5CO2H) | 4,2 |
Bau
Asam karboksilat memiliki bau yang menyengat. Yang paling umum adalah asam asetat pada cuka dan asam butanoat pada mentega tengik. Di sisi lain, ester dari asam karboksilat memiliki bau yang harum dan banyak digunakan untuk parfum.
Sintesis
Dalam industri
Sintesis asam karboksilat pada skala industri berbeda dengan sintesis untuk laboratorium karena membutuhkan peralatan khusus.
- Oksidasi aldehida dengan udara dengan bantuan katalis kobalt dan mangan. Aldehida dapat diperoleh dari alkena dengan hidroformilasi
- Oksidasi hidrokarbon dengan udara. Gugus alkil pada benzena teroksidasi menjadi asam karboksilat. Asam benzoat dari toluena dan asam tereftalat dari para-xilena, serta asam ftalat dari orto-xilena merupakan beberapa contoh konversi skala besar. Asam akrilat dihasilkan dari propena.[4]
- Dehidrogenasi alkohol dengan bantuan katalis basa.
- Karbonilasi. Metode ini efektif digunakan pada alkena yang menghasilkan karbokation sekunder dan tersier, contohnya isobutilena menjadi asam pivalat. Pada reaksi Koch, penambahan air dan karbon monoksida pada alkena dibantu katalis asam kuat. Asam asetat dan asam format didapatkan dari karbonilasi metanol, dengan bantuan iodida dan alkoksida.
- Beberapa asam karboksilat rantai panjang didapatkan dari hidrolisis trigliserida.
- fermentasi etanol digunakan dalam pembuatan cuka.
Dalam laboratorium
Metode sintesis dalam skala kecil untuk penelitian terkadang menggunakan reagen mahal.
- Oksidasi alkohol primer atau aldehida dengan oksidan kuat seperti kalium dikromat, reagen Jones, kalium permanganat, atau natrium klorit.[1]
- Pembelahan oksidatif olefin dengan ozonolisis, kalium permanganat, atau kalium dikromat.
- Asam karboksilat juga dapat diperoleh dari hidrolisis nitril,[1] ester, atau amida, dengan bantuan katalis asam atau basa.
- Karbonasi reagen Grignard dan organolitium:[1]
- RLi + CO2 → RCO2Li
- RCO2Li + HCl → RCO2H + LiCl
- Halogenasi diikuti hidrolisis metil keton pada reaksi haloform
- Reaksi Kolbe-Schmitt untuk membuat asam salisilat, bahan utama aspirin.
Penamaan dan contoh senyawa
Nama-nama asam karboksilat dapat dilihat pada tabel di bawah ini. Meskipun jarang digunakan, tetapi nama IUPAC juga tetap ada. Misalnya, nama IUPAC untuk asam butirat(C3H7CO2H) adalah asam butanoat.[5]
Anion karboksilat R-COO– biasanya dinamai dengan akhiran -at, jadi asam asetat, misalnya, menjadi ion asetat. Dalam tatanama IUPAC, asam karboksilat mempunyai akhiran -oat (contoh asam oktadekanoat). Dalam tatanama derifat, akhirannya adalah -at saja (contoh asam stearat).
| Atom karbon | Nama derifat | Nama IUPAC | Rumus molekul | Biasanya terdapat pada |
|---|---|---|---|---|
| 1 | Asam format | Asam metanoat | HCOOH | Gigitan serangga |
| 2 | Asam asetat | Asam etanoat | CH3COOH | Cuka |
| 3 | Asam propionat | Asam propanoat | CH3CH2COOH | Pengawet pada gandum |
| 4 | Asam butirat | Asam butanoat | CH3(CH2)2COOH | Mentega basi |
| 5 | Asam valerat | Asam pentanoat | CH3(CH2)3COOH | Valerian |
| 6 | Asam kaproat | Asam heksanoat | CH3(CH2)4COOH | Lemak kambing |
| 7 | Asam enantoat | Asam heptanoat | CH3(CH2)5COOH | |
| 8 | Asam kaprilat | Asam oktanoat | CH3(CH2)6COOH | Kelapa dan air susu ibu |
| 9 | Asam pelargonoat | Asam nonanoat | CH3(CH2)7COOH | Pelargonium |
| 10 | Asam kaprat | Asam dekanoat | CH3(CH2)8COOH | |
| 12 | Asam laurat | Asam dodekanoat | CH3(CH2)10COOH | Minyak kelapa dan sabun cuci tangan. |
| 14 | Asam miristat | Asam tetradekanoat | CH3(CH2)12COOH | Pala |
| 16 | Asam palmitat | Asam heksadekanoat | CH3(CH2)14COOH | Minyak palem |
| 18 | Asam stearat | Asam oktadekanoat | CH3(CH2)16COOH | Coklat, wax, sabun, dan minyak |
| 20 | Asam arakidat | Asam ikosanoat | CH3(CH2)18COOH | Peanut oil |
Reaksi
Reaksi yang paling banyak dipraktikkan ialah pengubahan asam karboksilat menjadi halida, anhidrida, ester, amida,[1] asam klorida,[6] garam karboksilat, dan alkohol.
Reaksi Dakin–West mengubah asam amino menjadi keton amino yang sesuai.
Lihat pula
- Amida
- Anhidrida asam
- Asam amino
- Asam dialkanoat
- Asam tioalkanoat
- Asam trialkanoat
- Asil klorida
- Daftar asam alkanoat
- Ester
- Karbon dioksida (CO2)
- Pseudoasam
- Turunan asam alkanoat
Referensi
- ^ a b c d e f g Yuliyanto, Eko (2018). Kimia Organik: Asam Karboksilat Berbasis Software Marvin Plus Refleks (PDF). Semarang: Unimus Press. ISBN 9786025614347. Pemeliharaan CS1: Status URL (link)
- ^ R.T. Morrison, R.N. Boyd. Organic Chemistry, 6th Ed. (1992) ISBN 0-13-643669-2.
- ^ (Inggris) Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (Edisi 92nd). CRC Press. hlm. 5–94 to 5–98. ISBN 1439855110.
- ^ Wilhelm Riemenschneider “Carboxylic Acids, Aliphatic” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a05_235 10.1002/14356007.a05_235.
- ^ Organic Chemistry IUPAC Nomenclature. Rules C-4 Carboxylic Acids and Their Derivatives. http://www.acdlabs.com/iupac/nomenclature/79/r79_24.htm
- ^ Rengga, Wara Dyah Pita; Putri, Rr Dewi Artanti. Kimia Organik I: Gugus Fungsi dalam Monomer. Perkumpulan Rumah Cemerlang Indonesia. ISBN 978-623-6478-43-1.
Pranala luar
- Carboxylic acids pH and titration – freeware for calculations, data analysis, simulation, and distribution diagram generation
- PHC.

