Selenium dioksida

| |
| |

| |
| Nama | |
|---|---|
| Nama lain
Selenium(IV) oksida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 3283 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| SeO2 | |
| Massa molar | 110.96 g/mol |
| Penampilan | Kristal putih, menjadi sedikit nila dengan sisa-sisa dekomposisi[1] |
| Bau | lobak busuk |
| Densitas | 3.954 g/cm3, padat |
| Titik lebur | 340 °C (644 °F; 613 K) (tabung yang disegel) |
| Titik didih | 350 °C (662 °F; 623 K) sublim |
| 38.4 g/100 mL (20 °C) 39.5 g/100 ml (25 °C) 82.5 g/100 mL (65 °C) | |
| Kelarutan | dapat larut dalam benzena |
| Kelarutan dalam etanol | 6.7 g/100 mL (15 °C) |
| Kelarutan dalam aseton | 4.4 g/100 mL (15 °C) |
| Kelarutan dalam asam asetat | 1.11 g/100 mL (14 °C) |
| Kelarutan dalam metanol | 10.16 g/100 mL (12 °C) |
| Tekanan uap | 1.65 kPa (70 °C) |
| Keasaman (pKa) | 2.62; 8.32 |
| −27.2·10−6 cm3/mol | |
| Indeks bias (nD) | > 1.76 |
| Struktur | |
| Lihat teks | |
| trigonal (Se) | |
| Bahaya | |
| Lembar data keselamatan | ICSC 0946 |
Klasifikasi UE (DSD) (usang)
|
Toxic (T) Dangerous for the environment (N) |
| Frasa-R | R23/25, R33, R50/53 |
| Frasa-S | (S1/2), S20/21, S28, S45, S60, S61 |
| Titik nyala | Tidak mudah terbakar |
| Dosis atau konsentrasi letal (LD, LC): | |
LCLo (terendah tercatat)
|
5890 mg/m3 (rabbit, 20 min) 6590 mg/m3 (goat, 10 min) 6590 mg/m3 (sheep, 10 min)[2] |
| Senyawa terkait | |
Anion lain
|
Selenium disulfida |
Kation lainnya
|
Sulfur dioksida Telurium dioksida |
| Selenium trioksida | |
Senyawa terkait
|
Asam selenit |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Selenium dioksida adalah senyawa kimia dengan rumus SeO2. Senyawa padat yang tidak berwarna ini merupakan salah satu senyawa selenium yang paling sering ditemui.
Properti
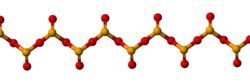
SeO2 padat merupakan senyawa polimer satu dimensi dan molekulnya berbentuk seperti rantai. Senyawa ini juga dianggap sebagai oksida asam: senyawa ini jika dilarutkan ke dalam air akan membentuk asam selenit.[3] Jika direaksikan dengan basa, senyawa ini akan membentuk garam selenit yang mengandung anion SeO2−3. Contohnya adalah dalam reaksi dengan natrium hidroksida yang menghasilkan natrium selenit:
- SeO2 + 2 NaOH → Na2SeO3 + H2O
Preparasi
Selenium dioksida dapat disiapkan dengan berbagai cara, seperti dengan mengoksidasi selenium, mereaksikannya dengan asam nitrat, atau mereaksikannya dengan hidrogen peroksida. Namun cara yang paling praktis adalah dengan mendehidrasikan asam selenit.
- 3 Se + 4 HNO3 + H2O → 3 H2SeO3 + 4 NO
- 2 H2O2 + Se → SeO2 + 2 H2O
- H2SeO3 ⇌ SeO2 + H2O
Kemunculan
Bentuk alami selenium dioksida (downeyit) merupakan mineral yang sangat langka. Mineral ini hanya dapat ditemukan di beberapa sampah pembakaran batu bara.[4]
Kegunaan
SeO2 merupakan reagen yang penting dalam proses sintesis organik. Oksidasi paraldehida dengan SeO2 akan menghasilkan glioksal[5] dan oksidasi sikloheksanona akan menghasilkan sikloheksana-1,2-dione.[6] Bahan awal selenium direduksi menjadi selenium dan mengalami pengendapan. Endapannya yang berwarna merah dapat dengan mudah disaring.[6] Reaksi semacam ini disebut oksidasi Riley.

Dapat juga dideskripsikan secara lebih umum:
- R2C=CR'-CHR"2 + [O] → R2C=CR'-C(OH)R"2
R, R', R" adalah substituen alkil atau aril
Referensi
- ^ http://www.integrachem.com/msds/S138_26294_101.pdf
- ^ "Selenium compounds (as Se)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ^ Finkelman, Robert B.; Mrose, Mary E. (1977). "Downeyite, the first verified natural occurrence of SeO2" (PDF). American Mineralogist. 62: 316–320.
- ^ Ronzio, A. R.; Waugh, T. D. (1955). "Glyoxal Bisulfite". Org. Synth.; Coll. Vol. 3: 438.
- ^ a b Hach, C. C. Banks, C. V.; Diehl, H. (1963). "1,2-Cyclohexanedione Dioxime". Org. Synth.; Coll. Vol. 4: 229.

