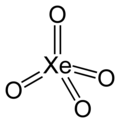
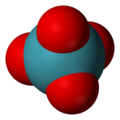
Xenon tetroksida
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Xenon tetraoksida
Xenon(VIII) oksida | |||
| Nama lain
Xenon tetroksida
Perxenat anhidrida | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChemSpider | |||
| Nomor EC | |||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| XeO4 | |||
| Massa molar | 195,29 g mol−1 | ||
| Penampilan | Padatan kuning pada suhu di bawah −36 °C | ||
| Titik lebur | −35,9 °C (−32,6 °F; 237,2 K) | ||
| Titik didih | 0 °C (32 °F; 273 K)[1] | ||
| Bereaksi | |||
| Struktur | |||
| Tetrahedral[2] | |||
| 0 D | |||
| Termokimia | |||
| Entalpi pembentukan standar (ΔfH |
+153,5 kcal mol−1 [3] | ||
| Bahaya | |||
| Bahaya utama | Bahan peledak yang kuat | ||
| Senyawa terkait | |||
Senyawa terkait
|
Xenon trioksida Asam perxenat | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Xenon tetroksida adalah sebuah senyawa anorganik yang terdiri dari xenon dan oksigen dengan rumus molekul XeO4, yang tidak biasa karena merupakan senyawa gas mulia yang relatif stabil. Senyawa ini memiliki wujud padatan kristalin berwarna kuning yang stabil di bawah suhu −35,9 °C; di atas suhu tersebut, senyawa ini sangat rentan meledak dan terurai menjadi xenon dan oksigen elemental (O2).[4][5]
Kedelapan elektron valensi xenon terlibat dalam ikatan dengan oksigen, dan keadaan oksidasi atom xenon adalah +8. Oksigen adalah satu-satunya unsur yang dapat membawa xenon ke keadaan oksidasi tertingginya; bahkan fluorin hanya dapat menghasilkan XeF6 (+6).
Dua senyawa xenon berumur pendek lainnya dengan keadaan oksidasi +8, XeO3F2 dan XeO2F4, dapat diperoleh melalui reaksi xenon tetroksida dengan xenon heksafluorida. XeO3F2 dan XeO2F4 dapat dideteksi melalui spektrometri massa. Perxenat juga merupakan senyawa dengan xenon yang memiliki bilangan oksidasi +8.
Reaksi
Pada suhu di atas −35,9 °C, xenon tetroksida sangat rentan meledak, terurai menjadi gas xenon dan oksigen dengan ΔH = −643 kJ/mol:
- XeO4 → Xe + 2 O2
Xenon tetroksida larut dalam air membentuk asam perxenat dan dalam alkali membentuk garam perxenat:
- XeO4 + 2 H2O → H4XeO6
- XeO4 + 4 NaOH → Na4XeO6 + 2 H2O
Xenon tetroksida juga dapat bereaksi dengan xenon heksafluorida menghasilkan xenon oksifluorida:
- XeO4 + XeF6 → XeOF4 + XeO3F2
- XeO4 + 2XeF6 → XeO2F4 + 2 XeOF4
Sintesis
Semua sintesis dimulai dari perxenat, yang dapat diperoleh dari xenat melalui dua metode. Salah satunya adalah disproporsionasi xenat menjadi perxenat dan xenon:
- 2 HXeO−4 + 2 OH− → XeO4−6 + Xe + O2 + 2 H2O
Yang lainnya adalah oksidasi xenat dengan ozon dalam larutan basa:
- HXeO−4 + O3 + 3 OH− → XeO4−6 + O2 + 2 H2O
Barium perxenat direaksikan dengan asam sulfat, dan asam perxenat yang tidak stabil didehidrasi sehingga menghasilkan xenon tetroksida:[6]
- Ba2XeO6 + 2 H2SO4 → 2 BaSO4 + H4XeO6
- H4XeO6 → 2 H2O + XeO4
Asam perxenat berlebih akan mengalami reaksi dekomposisi secara perlahan menjadi asam xenat dan oksigen:
- 2 H4XeO6 → O2 + 2 H2XeO4 + 2 H2O
Referensi
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (Edisi 87). Boca Raton, Florida: CRC Press. hlm. 494. ISBN 0-8493-0594-2.
- ^ G. Gundersen; K. Hedberg; J. L.Huston (1970). "Molecular Structure of Xenon Tetroxide, XeO4". J. Chem. Phys. 52 (2): 812–815. Bibcode:1970JChPh..52..812G. doi:10.1063/1.1673060.
- ^ Gunn, S. R. (Mei 1965). "The Heat of Formation of Xenon Tetroxide". Journal of the American Chemical Society. 87 (10): 2290–2291. doi:10.1021/ja01088a038.
- ^ H.Selig, J. G. Malm, H. H. Claassen, C. L. Chernick, J. L. Huston (1964). "Xenon tetroxide – Preparation & Some Properties". Science. 143 (3612): 1322–3. Bibcode:1964Sci...143.1322S. doi:10.1126/science.143.3612.1322. JSTOR 1713238. PMID 17799234. S2CID 29205117. Pemeliharaan CS1: Banyak nama: authors list (link)
- ^ J. L. Huston; M. H. Studier; E. N. Sloth (1964). "Xenon tetroxide — Mass Spectrum". Science. 143 (3611): 1162–3. Bibcode:1964Sci...143.1161H. doi:10.1126/science.143.3611.1161-a. JSTOR 1712675. PMID 17833897. S2CID 28547895.
- ^ A. Earnshaw; Norman Greenwood (1997). Chemistry of the Elements (Edisi 2). Elsevier. hlm. 901. ISBN 9780080501093.
- Lide, D. R., ed. (2002). CRC Handbook of Chemistry and Physics (Edisi 83). Boca Raton, Florida: CRC Press. ISBN 0-8493-0483-0.