Timah(IV) oksida
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Tin(IV) Oxide
| |
| Nama lain | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| O2Sn | |
| Massa molar | 150,71 g·mol−1 |
| Penampilan | Serbuk putih atau abu-abu muda[2] |
| Bau | Tak berbau |
| Densitas | 6,95 g/cm3 (20 °C)[3] 6,85 g/cm3 (24 °C)[4] |
| Titik lebur | 1.630 °C (2.970 °F) [3][4] |
| Titik didih | 1.800 °C (3.270 °F)-1.900 °C (3.450 °F) Menyublim[3] |
| Tak larut[4] | |
| Kelarutan | Larut dalam basa pekat panas,[4] asam pekat Tidak larut dalam alkohol[3] |
| −4,1·10−5 cm3/mol[4] | |
| Indeks bias (nD) | 2,006[5] |
| Struktur | |
| Rutil tetragonal, tP6[6] | |
| P42/mnm, No. 136[6] | |
| 4/m 2/m 2/m[6] | |
a = 4,737 Å, c = 3,185 Å[6] α = 90°, β = 90°, γ = 90°
| |
| Oktahedral (Sn4+) Trigonal planar (O2−) | |
| Termokimia | |
| Kapasitas kalor (C) | 52,6 J/mol·K[4] |
| Entropi molar standar (S |
49,04 J/mol·K[4][7] |
| Entalpi pembentukan standar (ΔfH |
−577,63 kJ/mol[4][7] |
| Energi bebas Gibbs (ΔfG) | −515,8 kJ/mol[4] |
| Bahaya | |
| Lembar data keselamatan | ICSC 0954 |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
> 20 g/kg (rats, oral)[8] |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
none[2] |
REL (yang direkomendasikan)
|
TWA 2 mg/m3[2] |
IDLH (langsung berbahaya)
|
N.D.[2] |
| Senyawa terkait | |
| Timah(II) oksida | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Timah(IV) oksida, juga dikenal sebagai stanni oksida, adalah senyawa anorganik dengan rumus SnO2. Bentuk mineral SnO2 adalah kasiterit, dan ini adalah bijih utama timah.[9] Dengan banyaknya nama lain, oksida timah ini adalah bahan baku paling penting dalam industri timah. Ia berupa padatan tak berwarna, diamagnetik, dan amfoter.
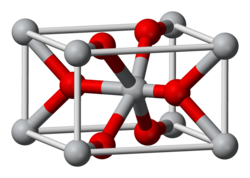
Struktur

Ia mengkristal dengan struktur rutil. Dengan demikian atom timah adalah koordinasi enam dan atom oksigen adalah koordinasi tiga.[9] SnO2 biasanya dianggap sebagai semikonduktor tipe n yang kekurangan oksigen.[10]
Bentuk hidrat dari SnO2 disebut sebagai asam stanat. Bahan semacam itu tampak sebagai partikel terhidrasi dari SnO2 dimana komposisinya mencerminkan ukuran partikel.[11]
Preparasi
Timah(IV) oksida terjadi secara alami. Timah(IV) oksida sintetis diproduksi dengan membakar logam timah di udara.[11] Produksi tahunan berkisar 10 kiloton.[11] SnO2 direduksi secara industri menjadi logam dengan karbon di tungku reverberatory pada 1200-1300 °C.[12]
Amfoterisme
Meskipun SnO tidak larut dalam air, ia bersifat amfoterik, larut dalam basa dan asam.[13] "Asam stanat" mengacu pada timah(IV) oksida, SnO2, terhidrasi yang juga disebut "stani hidroksida."
Timah oksida larut dalam asam. Asam halogen menyerang SnO2 menghasilkan heksahalostanat,[14] misalnya [SnI''";. Satu laporan menggambarkan reaksi sampel saat direfluks dengan HI selama berjam-jam.[15]
- SnO + 6 HI → H + 2 H
Demikian pula, SnO2 larut dalam asam sulfat membentuk stani sulfat:[11]
- SnO + 2 H → Sn(SO''"; + 2 H
SnO larut dalam basa kuat membentuk "stanat", dengan rumus nominal Na.[11] Melarutkan padatan SnO/lelehan NaOH dalam air membentuk Na, "preparat garam," yang digunakan dalam industri pewarna.[11]
Kegunaan
Dalam hubungannya dengan vanadium oksida, stanni oksida digunakan sebagai katalis untuk oksidasi senyawa aromatik dalam sintesis asam karboksilat dan anhidrida asam.[9]
Glasir keramik
Timah(IV) oksida telah lama digunakan sebagai opasifier dan sebagai pewarna putih di glasir keramik.[16] Hal ini mungkin yang mengarahkan pada penemuan pigmen timbal-timah-kuning, yang diproduksi dengan menggunakan timah(IV) oksida.[17] Penggunaan timah(IV) oksida telah sangat umum pada pengglasiran gerabah, saniter dan ubin dinding; lihat artikel glasir timah dan tembikar berglasir timah. Oksida timah tetap berbentuk suspensi dalam matriks vitreous pada glasir yang dibakar, dan, dengan indeks biasnya yang tinggi yang cukup berbeda dari matriks, cahaya tersebar, dan karenanya meningkatkan opasitas glasir. Tingkat peleburan meningkat sebanding dengan suhu pembakaran, dan karenanya tingkat opasitas berkurang.[18] Meskipun tergantung pada konstituen lain, kelarutan timah oksida dalam lelehan glasir pada umumnya rendah. Kelarutannya dinaikkan oleh Na, K dan B, dan dikurangi dengan CaO , BaO, ZnO, Al, dan sampai batas tertentu PbO.[19]
SnO2 telah digunakan sebagai pigmen dalam pembuatan gelas, enamel dan glasir keramik. SnO2 murni memberi warna putih susu; warna lain diperoleh bila dicampur dengan oksida logam lainnya mis. V kuning; Cr pink; dan biru abu-abu Sb.[11]
Pemoles
Timah(IV) oksida dapat digunakan sebagai serbuk pemoles,[11] terkadang dalam campuran juga dengan timbal oksida, untuk memoles kaca, perhiasan, marmer dan perak.[1] Timah(IV) oksida untuk penggunaan ini kadang disebut "bubuk dempul"[13] atau "dempul perhiasan".[1]
Penyalut kaca
Penyalutan SnO2 dapat diterapkan dengan menggunakan deposisi uap kimia, teknik deposisi uap yang menggunakan SnCl4[9] atau trihalida organotimah[20] misalnya Butiltimah triklorida sebagai zat volatil. Teknik ini digunakan untuk meyalut botol kaca dengan lapisan tipis (<0,1 μm) SnO2, yang membantu menempelkan lapisan pelindung polimer berikutnya seperti polietilena ke kaca.[9]
Lapisan yang lebih tebal yang didoping dengan ion Sb atau F adalah penghantar listrik dan digunakan pada perangkat elektroluminesen.[9]
Penginderaan gas
SnO2 digunakan dalam sensor gas yang mudah terbakar termasuk detektor karbon monoksida. Pada penggunaan ini, area sensor dipanaskan sampai suhu konstan (beberapa ratus °C) dan dengan adanya gas yang mudah terbakar, resistivitas listrik turun.[21] Doping dengan berbagai senyawa telah diteliti (mis. dengan CuO[22]). Doping dengan kobalt dan mangan, menghasilkan bahan yang dapat digunakan pada, misalnya, varistor tegangan tinggi.[23] Timah(IV) oksida dapat didoping dengan oksida besi atau mangan.[24]
Referensi
- ^ a b c "Material Name: stannic oxide". Museum of Fine Arts, Boston. 2007-02-10. Diarsipkan dari asli tanggal 2012-11-04. Diakses tanggal 2013-03-29.
- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0616". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d CID 29011 dari PubChem
- ^ a b c d e f g h i Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (Edisi 90). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. hlm. 940. ISBN 0-07-049439-8.
- ^ a b c d Baur, W.H. (1956). "Über die Verfeinerung der Kristallstrukturbestimmung einiger Vertreter des Rutiltyps: TiO2, SnO2, GeO2 und MgF2". Acta Crystallographica. 9 (6): 515–520. doi:10.1107/S0365110X56001388.
- ^ a b Stannic oxide dalam Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (diakses tanggal 2014-07-04)
- ^ a b "MSDS of Tin(IV) oxide", https://www.fishersci.ca, Fisher Scientific, diakses tanggal 2014-07-04
- ^ a b c d e f Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. hlm. 447–48. ISBN 0-08-022057-6.
- ^ Solid State Chemistry: An Introduction, CRC Press, 2005, ISBN 0-7487-7516-1
- ^ a b c d e f g h Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ^ J.L. Wardell (1995), R. Bruce King (ed.), "Tin: Inorganic chemistry", Encyclopedia of Inorganic Chemistry, John Wiley & Son Ltd., ISBN 0-471-93620-0
- ^ a b F. Sherwood Taylor (1942), Inorganic & Theoretical chemistry (Edisi 6th), Heineman
- ^ Donaldson & Grimes (1989), P.G. Harrison Blackie (ed.), Chemistry of tin
- ^ Earle R. Caley (1932). "The Action Of Hydriodic Acid On Stannic Oxide". J. Am. Chem. Soc. 54 (8): 3240–3243. doi:10.1021/ja01347a028.
- ^ A.B.Searle (1935), The Glazer’s Book (Edisi 2nd), London: The Technical Press Limited
- ^ Hermann Kühn (1967), "Blei-Zinn-Gelb und seine Verwendung in der Malerei", Farbe und Lack, 73: 938–949
- ^ E.Bourry (1926), A Treatise On Ceramic Industries (Edisi 4th), London: Scott, Greenwood & son
- ^ C.W.Parmelee & C.G.Harman (1973), Ceramic Glazes (Edisi 3rd), Boston, Massachusetts: Cahners Books
- ^ US 4130673
- ^ Joseph Watson, Sensors Nanoscience Biomedical Engineering and Instruments (ed.), "The stannic oxide semiconductor gas sensor", The Electrical engineering Handbook (Edisi 3rd), R.C Dorf: CRC Press Taylor and Francis, ISBN 0-8493-7346-8
- ^ Wang, Chun-Ming; Wang, Jin-Feng; Su, Wen-Bin (2006). "Microstructural Morphology and Electrical Properties of Copper- and Niobium-Doped Tin (IV) oxide Polycrystalline Varistors" (PDF). Journal of the American Ceramic Society. 89 (8): 2502–2508. doi:10.1111/j.1551-2916.2006.01076.x.
- ^ Dibb A.; Cilense M; Bueno P.R; Maniette Y.; Varela J.A.; Longo E. (2006). "Evaluation of Rare Earth Oxides doping SnO2.(Co0.25,Mn0.75)O-based Varistor System". Materials Research. 9 (3): 339–343. doi:10.1590/S1516-14392006000300015.
- ^ A. Punnoose; J. Hays; A. Thurber; M. H. Engelhard; R. K. Kukkadapu; C. Wang; V. Shutthanandan; S. Thevuthasan (2005). "Development of high-temperature ferromagnetism in SnO2 and paramagnetism in SnO by Fe doping". Phys. Rev. B. 72 (8): 054402. doi:10.1103/PhysRevB.72.054402.
Bacaan lebih lanjut
- (Inggris) "How Pilkington Energy Advantage™ Low-E Glass Works" (PDF). Pilkington Group Limited. 18 July 2005. Diakses tanggal 2012-12-02.[pranala nonaktif permanen] Diskusi teknis mengenai cara penggunaan SnO2:F digunakan dalam jendela rendah emisivitas (low-E). Laporan tersebut mencakup spektrum reflaktansi dan transmitasi.
- (Inggris) "NIOSH Pocket Guide to Chemical Hazards - Tin(IV) oxide (as Sn)". Centers for Disease Control and Prevention. 4 April 2011. Diakses tanggal 2013-11-05. Informasi mengenai batas keselamatan dan paparan bahan kimia.

